Набор реагентов для качественного иммуноферментного определения антител класса G к коронавирусу SARS-CoV-2 и индекса их авидности в сыворотке или плазме крови человека «SARS-CoV-2-ИФА-IgG плюс» (в настоящее время предлагается для научных исследований)
Ави́дность антител (лат. avidus — «жадный») — характеристика общей стабильности комплекса антигена и антитела. Авидность определяется аффинностью (силой связывания) антитела к антигену, количеством антигенсвязывающих центров в молекуле антитела и особенностями пространственной структуры антигена, создающими стерические препятствия для создания комплекса.
Согласно классическим иммунологическим представлениям, авидность увеличивается со временем. В течение начального периода иммунизации антитела являются, в основном, низкоавидными, поскольку для иммунной системы важнее скорость и количество наработки антител, нежели сила их связывания с новым антигеном. В дальнейшем, после окончания активной фазы иммунной реакции (то есть после выздоровления или вакцинации), происходит постепенное созревание и селекция B-клеток – продуцентов иммуноглобулинов – которые становятся все более специфичными по отношению к антигену. Этот процесс формирования устойчивого иммунитета, называемый матурацией (созреванием) антител класса G и продуцирующих их В-клеток иммунологической памяти, приводит к повышению авидности антител. В упрощенном виде схема развития и матурации компонентов гуморального иммунного ответа представлена на рисунке А [иллюстрация из Bauer, 2020 ]:
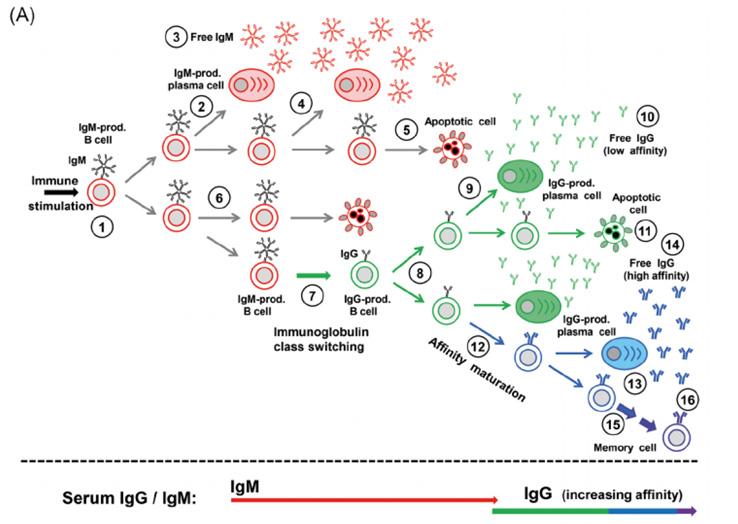
В условиях лаборатории обычно определяют индекс авидности антител, выражаемый в процентах (ИА%). Чем выше индекс авидности, тем более высокоавидные антитела присутствуют в образце.
Разработанный компанией МедипалТех набор реагентов «SARS-CoV-2-ИФА+ИА-IgG» позволяет определять индекс авидности IgG к коронавирусу SARS-CoV-2, достоверно дифференцируя антитела на низкоавидные (ИА ≤ 40%) и высокоавидные (ИА ≥ 50%).
Клиническое значение ИА основано на имеющихся литературных данных. Показано, что для острой стадии заболевания COVID-19 и ранней стадии реконвалесценции (0-45 дней после первичной иммунизации) характерно наличие в крови антител с низким индексом авидности [Liu et al., 2020]. Основываясь на аналогичных данных, полученных для инфекции близкородственным возбудителем SARS-CoV-1 [Chan et al., 2007], предполагается, что антитела к коронавирусу SARS-CoV-2 приобретают высокий индекс авидности в течение 90 дней после инфекции [Bauer, 2020]. В общем случае, определение антител с низким индексом авидности является показателем недавно (до 45 дней) перенесенной первичной инфекции, а наличие высокоавидных – признаком успешного завершения матурации B-клеток и формированием устойчивого гуморального иммунитета [Gutierrez et al., 1996; Sulgoi et al., 2002; Revello et al., 2002; De Souza et al., 2004; Zhang et al., 2017]. Факт появления высокоавидных антител также связывают с эффективностью иммунизации против вакциноуправляемых инфекций [Usinger & Lucas, 1999; Dobano et al., 2019].
Набор реагентов «SARS-CoV-2-ИФА+ИА-IgG» может быть использован не только для определения индекса авидности антител, но и как скрининговый тест для качественного определения IgG к коронавирусу SARS-CoV-2. При постановке на авидность набор рассчитан на 96 определений, а в скрининговом варианте – на 192 определения, включая контрольные.
Производится под заказ от 1000 наборов.

Список источников:
Bauer, G. The variability of the serological response to SARS-corona virus-2: potential resolution of ambiguity through determination of avidity (functional affinity). J. Med. Virol. https://doi.org/10.1002/jmv.26262 (2020).
Chan, K. H. et al. Use of antibody avidity assays for diagnosis of severe acute respiratory syndrome coronavirus infection. Clin. Vaccin. Immunol. 14, 1433–1436 (2007).
De Souza, V. A. U. F. et al. Use of an immunoglobulin G avidity test to discriminate between primary and secondary Dengue virus infections. J. Clin. Microbiol. 42, 1782–1784 (2004).
Dobano, C. et al. Concentration and avidity of antibodies to different circumsporozoite epitopes correlate with RTS,S/AS01E malaria vaccine efficacy. Nat. Commun. 10, 2174 (2019).
Liu, T., Hsiung, J., Zhao, S. et al. Quantification of antibody avidities and accurate detection of SARS-CoV-2 antibodies in serum and saliva on plasmonic substrates. Nat Biomed Eng (2020). https://doi.org/10.1038/s41551-020-00642-4
Gutierrez, J. & Maroto, C. Are IgG antibody avidity assays useful in the diagnosis of infectious diseases? A review. Microbios 87, 113–121 (1996).
Revello, M. G. et al. Diagnosis and outcome of preconceptional and periconceptional primary human cytomegalovirus infections. J. Infect. Dis. 186, 553–557 (2002).
Suligoi, B. et al. Precision and accuracy of a procedure for detecting recent human immunodeficiency virus infections by calculating the antibody avidity index by an automated immunoassay-based method. J. Clin. Microbiol. 40, 4015–4020 (2002).
Zhang, B. et al. Diagnosis of Zika virus infection on a nanotechnology platform. Nat. Med. 23, 548–550 (2017).
Usinger, W. R. & Lucas, A. H. Avidity as a determinant of the protective efficacy of human antibodies to pneumococcal capsular polysaccharides. Infect. Immun. 67, 2366–2370 (1999).




